معرفی جامع عوامل اکسیداسیون؛ پراکسیدها و اکسیدکننده ها

پراکسیدها و اکسنده ها | اهمیت فرآیند اکسیداسیون و کاربردهای آن
پراکسیدهای معدنی و آلی به دلیل واکنش پذیری استثنایی و پتانسیل اکسیداتیو به طور گسترده در آزمایشگاه های تحقیقاتی مورد استفاده قرار می گیرند. پیوند نسبتاً ضعیف اکسیژن-اکسیژن ساختار مشخصه مولکول های پراکسید آلی و معدنی است و مبنای واکنش پذیری و تمایل آنها به تجزیه خود به خودی است. ضعف غیرمعمول پیوند -O-O- احتمالاً نتیجه ساختار مولکولی و الکترونیکی مولکولهای پراکسید و ویژگی الکترونگاتیو نسبتاً بالای اتمهای اکسیژن است. به عنوان یک کلاس، پراکسیدها به طور استثنایی مستعد تجزیه شدید هستند که می تواند توسط گرما، شوک مکانیکی یا اصطکاک، به ویژه در حضور کاتالیزورها و پروموترهای خاص آغاز شود. در این مقاله، به بررسی اهمیت شناخت پراکسیدها و اکسیدکننده ها و کاربردهای آن ها و فرآیند اکسیداسیون می پردازیم.
همچنین بخوانید:
♣ اسید استیک چیست؟ | خواص، انواع و کاربردها
♣ اسید نیتریک | از ماده اولیه تا کاربردهای صنعتی
عامل اکسیداسیون(اکسنده) چیست؟
یک عامل اکسیدکننده، که اغلب به عنوان اکسنده یا اکسیدان نامیده می شود، گونه ای شیمیایی است که تمایل به اکسید کردن سایر مواد دارد. یعنی با از دست دادن الکترون، باعث افزایش در حالت اکسیداسیون ماده می شود. نمونه های متداول عوامل اکسید کننده (پراکسیدها و اکسیدکننده ها)؛ شامل هالوژن ها (مانند کلر و فلوئور)، اکسیژن و پراکسید هیدروژن (H2O2) است.
فرآیند ردوکس (اکسیداسیون) چیست؟
واکنش های ردوکس واکنش های شیمیایی اکسایش-کاهش هستند که در آن واکنش دهنده ها دچار تغییر در حالت اکسیداسیون خود می شوند. اصطلاح ‘redox’ فرم کوتاه شده reduction-oxidation است. تمام واکنش های پراکسیدها و اکسیدکننده ها می تواند به دو فرآیند مختلف تقسیم شود : یک فرآیند کاهش (احیا) و یک فرآیند اکسایش. واکنش های اکسایش و کاهش همیشه در واکنش ردوکس همزمان اتفاق می افتد. ماده ای که در واکنش شیمیایی کاهش می یابد به عنوان عامل اکسید کننده (اکسنده) شناخته می شود، در حالی که ماده ای که اکسید می شود به عنوان عامل احیا کننده(کاهنده) شناخته می شود.
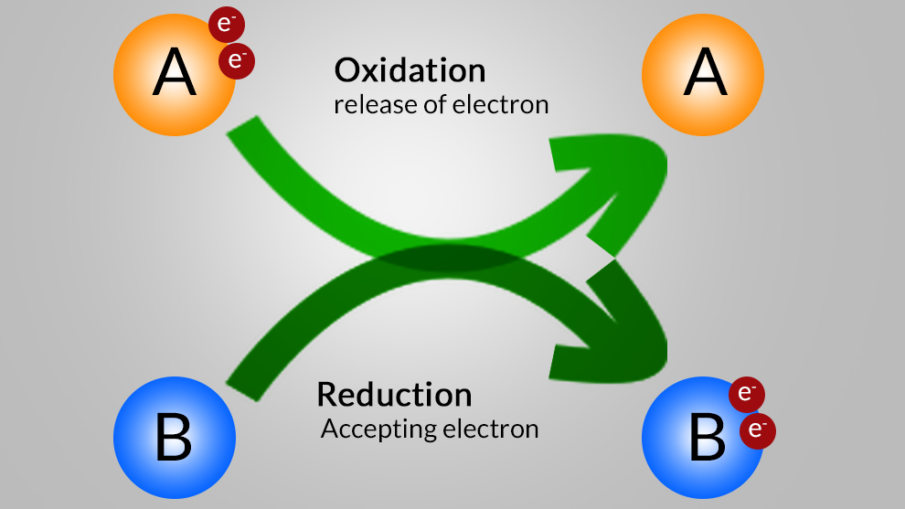
پراکسید یا اکسیدکننده چیست؟
بر اساس دریافت یا از دست دادن الکترون، دو تعریف متفاوت برای پراکسید وجود دارد که در زیر به شرح هر یک بطور جداگانه می پردازیم:
الف) به عنوان یک پذیرنده الکترون:
پراکسیدها و اکسیدکننده هایی از این دست، مواد شیمیایی هستند که اتم های آنها در واکنش شیمیایی حداقل یک الکترون را از اتم دیگر حذف می کنند. طبق این تعریف، عوامل اکسید کننده، واکنش دهنده هایی هستند که تحت واکنش های اکسیداسیون کاهش می یابند. تصویر زیر جزئیات خواص پذیرش الکترون از عوامل اکسید کننده را نمایش می دهد.
در اینجا، ماده “A” تحت اکسیداسیون قرار می گیرد، در نتیجه عدد اکسایش آن افزایش می یابد. از طرف دیگر، عدد اکسایش ماده “B” کوچکتر می شود (زیرا تحت کاهش، الکترون می پذیرد).
ب) به عنوان یک ماده انتقال دهنده اتم:
یک عامل اکسید کننده ماده ای است که در یک واکنش شیمیایی حداقل یک اتم الکترونگاتیو (الکترون منفی) را به یک نوع شیمیایی منتقل می کند. اتم منتقل شده به طور معمول یک اتم اکسیژن است. چندین واکنش احتراق و واکنش های ردوکس آلی شامل انتقال یک اتم الکترون منفی بین دو واکنش دهنده است.
چه عواملی بر قدرت اکسیدکنندگی پراکسیدها و اکسیدکننده ها تأثیر می گذارد؟
عوامل اکسید کننده معمولاً در بالاترین حالت اکسیداسیون ممکن خود وجود دارند و بنابراین تمایل زیادی به پذیرش الکترون و یا کاهش آن دارند. یون ها، اتم ها و مولکول هایی که میل زیادی به الکترون دارند، اکسید کننده های خوبی محسوب می شوند. هر چه میل الکترون بیشتر باشد، قدرت اکسیداسیون آن بیشتر است. گفته می شود که فلوئور عنصری، قوی ترین عامل اکسیدکننده عناصر است. این امر شاید به این دلیل باشد که فلوئور، منفی ترین الکترون در جدول تناوبی مدرن است و بنابراین در بین همه عناصر قوی ترین نیروی جاذبه را به الکترون وارد می کند.
در جدول زیر، می توانید برخی از عوامل اکسنده و کاهنده را مشاهده نمایید:
| عوامل کاهنده | عوامل اکسنده |
|---|---|
| کربن (C) | بروم(Br2) |
| مونواکسید کربن(CO) | کلر(Cl2) |
| هیدروژن (H2) | اسید سولفوریک غلیظ(H2SO4) |
| سولفید هیدروژن(H2S) | اسید نیتریک(HNO3) |
| فلزات | اکسیژن(O2) |
| یدید پتاسیم (KI) | منگنات پتاسیم(KMnO4) |
| دی اکسید سولفور(SO2) | دی کرومات پتاسیم(K2Cr2O7) |
| آمونیوم (NH3) | پراکسید هیدروژن(H2O2) |
در حقیقت، قدرت اکسیداسیون فلوئور دواتمی (F2) به اندازه کافی قوی است که باعث می شود فلزاتی مانند آزبست و کوارتز (و حتی مولکول هایی مانند آب) هنگام قرار گرفتن در معرض آن، شعله ور شوند. چند مثال دیگر از عوامل اکسیداسیون بنیادی شامل اکسیژن دواتم (O2) ، کلر دواتمی (Cl2) و ازن (O3) است. این اکسیدکننده ها اشکال اصلی عناصر دوم و سوم منفی الکتریکی هستند (به ترتیب اکسیژن و کلر)، و آنها را به عنوان پذیرنده های الکترونی مناسب تبدیل می کنند. پتانسیل الکترود استاندارد یک نیم واکنش در یک فرآیند ردوکس، نگرشی را در مورد قدرت اکسیداسیون ماده شیمیایی فراهم می کند. تصویری که برخی اکسیدکننده ها را از نظر قدرت اکسید کنندگی آنها رتبه بندی می کند، در زیر آورده شده است.
برخی از ترکیباتی که حالت اکسیداسیون قوی از خود نشان می دهند، نیز می توانند عوامل اکسید کننده خوبی در نظر گرفته شوند. نمونه های یونی شامل یون پرمنگنات، یون کرومات و یون دیکرومات است.
کاربرد اکسید کننده ها چیست؟
عوامل اکسید کننده کاربردهای تجاری و صنعتی بی شماری دارند. تعدادی از این کاربردها در زیر ذکر شده است:
- سفید کردن پارچه ها
- تصفیه آب
- احتراق سوخت شامل استفاده از یک عامل اکسید کننده
- ذخیره انرژی در باتری ها
- ولکانش لاستیک (افزایش مقاومت و کشش لاستیک)
- پراکسیدها و اکسیدکننده ها برای بسیاری از فرآیندهای بیولوژیکی مانند متابولیسم و فتوسنتز نیز حیاتی هستند.
اکسنده های رایج:
فهرستی از اکسنده های رایج در صنعت شیمیایی، ذر زیر آورده شده است:
1) هالوژن ها
عناصر گروه 17 جدول تناوبی (عناصرگروه 7 اصلی) در مجموع به عنوان هالوژن شناخته می شوند. گفته می شود که آنها توانایی بالایی در به دست آوردن الکترون دارند، که به دلیل الکترونگاتیوی (منفی بودن الکترون) در مقایسه با عناصر گروههای دیگر است. این بدان معنی است که آنها به راحتی می توانند الکترون به هسته های مربوطه جذب کنند. نمونه هایی از هالوژن هایی که عوامل اکسیدکننده خوبی هستند شامل ید، برم، کلر و فلوئور هستند.
همه چهار هالوژن عنصری، بر اساس نیم واکنش زیر، توانایی پذیرش الکترون را دارند:
که در آن: X=F, Cl, Br, I
همانطور که ممکن است از تغییر دوره ای الکترونگاتیوی انتظار داشته باشیم، قدرت اکسیداسیون هالوژن ها به ترتیب F2> Cl2> Br2> I2 کاهش می یابد. فلوئور به دلیل بالاترین میزان الکترونگاتیویته، قوی ترین عامل اکسید کننده اصلی است. فلورین یک ماده اکسنده قوی است که می تواند با آب واکنش دهد (اکسیداسیون آب بسیار دشوار است):
2) اکسیژن
اکسیژن عنصر مربوط به عدد اتمی 8 است و با نماد ‘O’ نشان داده می شود. این ماده به گروه کالکوژن جدول تناوبی تعلق دارد و یک غیر فلز بسیار واکنش پذیر است که دارای خواص اکسید کننده خوبی است. به طور کلی، به دلیل قدرت اکسید کنندگی شدید اکسیژن، فلزات تمایل دارند با واکنش با اکسیژن اتمسفر، اکسیدهای فلز تشکیل دهند. اکسیژن، بخش اعظمی از اکثر واکنش های احتراق است. گاز اکسیژن، که حدود 20 درصد از جو زمین را تشکیل می دهد، بسیار کمی ضعیف تر از کلر است، اما بطور قابل توجهی قوی تر از برم است.
شکل اکسید شده سیلیکون، SiO2، یکی از ترکیبات بسیار زیاد پوسته زمین است. اکثر فلزات نیز اکسید می شوند و باید قبل از دستیابی به شکل اولیه، آنها را کاهش داد. وقتی آهن زنگ می زند، اکسید قهوه ای قرمز Fe2O3 • xH2O را که در زیر مشاهده می شود، تشکیل می دهد که همیشه حاوی مقدار نامشخصی آب است.
3) اکسی آنیون و اکسی اسید
در محلول های آبی NO3– ، IO3– ،MnO4– ، Cr2O72 و تعدادی دیگر از اکسی آنیون ها به عنوان عوامل اکسید کننده مناسب و قوی عمل می کنند. اکسی آنیون های قوی اکسید کننده اغلب حاوی عنصری در بالاترین حالت اکسیداسیون ممکن خود هستند، یعنی با یک عدد اکسایش برابر با عدد گروه تناوبی. به عنوان مثال، NO3– حاوی نیتروژن در حالت اکسیداسیون 5+، Cr2O72 حاوی کروم 6+ است و دارای منگنز 7+ است. از قدرت اکسیداسیون یون دی کرومات در محلول تمیز کردن آزمایشگاه، یعنی محلول Na2Cr2O7 در H2SO4 غلیظ استفاده می شود. این ترکیب، به راحتی ترکیبات آلی موجود در گریس را به دی اکسید کربن اکسید می کند. همچنین بسیار خورنده است. یون پرمنگنات بنفش تیره یکی دیگر از عوامل اکسید کننده بسیار رایج است در محلول اولیه به MnO2 قهوه ای تیره جامد کاهش می یابد، هرچند در محلول اسیدی، تقریباً Mn2+ بی رنگ تشکیل می شود.
4) پراکسید هیدروژن یا آب اکسیژنه
آب اکسیژنه یک ترکیب شیمیایی با فرمول H2O2 است. پراکسید هیدروژن هم به عنوان یک ماده اکسنده و هم به عنوان یک ماده کاهنده عمل می کند. به صورت مایعی بی رنگ به نظر می رسد که دارای گرانروی بیشتری نسبت به آب است. پراکسید هیدروژن ساده ترین ترکیب دارای یک گروه عملکردی پراکسید با یک پیوند اکسیژن و اکسیژن است. این ماده به عنوان یک ماده اکسید کننده ضعیف، ضد عفونی کننده و یک ماده سفید کننده استفاده می شود. هرچند در محلول اسیدی، خاصیت اکسیدکنندگی نسبتا قوی پیدا میکند.
بسیاری از عوامل اکسید کننده دیگر معمولاً به صورت صنعتی و همچنین در زندگی روزمره انسانها استفاده می شود. به عنوان مثال می توان به سدیم هیپوکلریت به عنوان سفید کننده خانگی (NaOCl) و نیترات پتاسیم (KNO3) اشاره کرد.
5) اسیدهای اکسیدکننده شامل؛ اسید فرمیک
نمونه های اسیدی اکسید کننده های خوبی هستند که الکترونگاتیوی مولکول های آن ها با افزایش عدد اکسایش اتم ها افزایش یافته و توانایی آنها را در اکسید کردن مواد دیگر، افزایش می دهد. اسید های اکسیدکننده شامل موارد زیر است:
- اسید نیتریک (HNO₃)
- اسید پرکلریک (HClO4)
- اسید کلریک (HClO3)
- کرومیک اسید(H2CrO4)
- اسید سولفوریک (H2SO4)
- اسید فرمیک (CH₂O₂)
- متا-کلروپروکسیبنزوئیک اسید (C7H5ClO3)
- یدوکسی2 بنزوئیک اسید (C7H5IO4)
- پریودیک اسید (H5IO6)
- پراکسی اسید acidic –OOH group
- تریبرموایزوسیانوریک اسید (C3Br3N3O3)
- تریکلروایزوسیانوریک اسید (C3Cl3N3O3)
- پراستیک اسید(C₂H₄O₃)
همچنین بخوانید:
♣ مقایسه اسیدفرمیک و پراستیک اسید در فرآیند گوگردزدایی
♣ حذف سولفید هیدروژن از آب ترش
پراکسید چیست؟
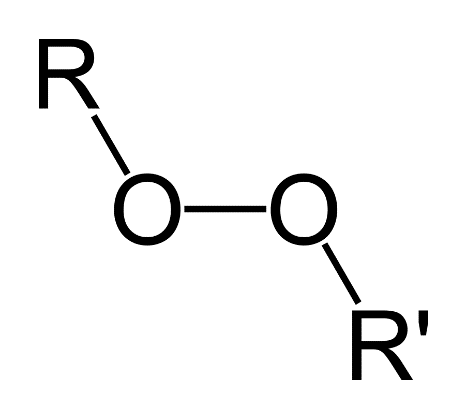
پراکسید، هر دسته از ترکیبات شیمیایی است که در آن دو اتم اکسیژن توسط یک پیوند کووالانسی واحد به هم متصل می شوند. پراکسیدها گروهی از ترکیبات هستند که دارای ساختار R-O-O-R می باشند. گروه O-O، گروه موجود در پراکسید، همچنین گروه پراکسو یا گروه پروکسید نامیده می شود. برخلاف یون های اکسید، اتم های اکسیژن موجود در یون پراکسید، دارای عدد اکسایش 1- هستند. چندین پراکسید آلی و غیر آلی به عنوان عوامل سفید کننده استفاده می گردند.
دو دسته پراکسید وجود دارد که در آن یکی یا هر دو اتم اکسیژن به صورت کووالانسی با اتم های دیگری به غیر از هیدروژن مرتبط هستند:
- یک دسته توسط کومن هیدروپراکسید (C9H12O2)، یک ترکیب آلی که به عنوان یک آغازگر(Initiator) پلیمریزاسیون و به عنوان منبع فنول و استون و اسید پراکسی سولفوریک استفاده میشود، یک ترکیب غیر آلی است که به عنوان یک ماده اکسیدکننده استفاده میشود.
- دسته دیگر شامل دیترتبوتیلپراکسید (C8H18O2) و آمونیوم پرسولفات ((NH4)S2O8) است که هر دو به عنوان آغازگراستفاده میشوند.
انواع پراکسیدها
از متداولترین پراکسیدها و اکسیدکننده ها، پراکسیدهیدروژن یا آب اکسیژنه (H2O2) است که اصطلاحاً پراکسید هم نامیده می شود. به غیر از پراکسیدهیدروژن، تعداد اندکی از دسته های پراکسیدها به شرح زیر است:
- پراکسی اسیدها که مشتق های پراکسی از چندین اسید نام آشنا هستند: پراستیک اسید(C₂H₄O₃)، پروکسیمونوسولفوریک اسید(H2SO5) و نمک های آنها که پتاسیم پرسولفات (K2S2O8) نمونه ای از آن است.
- پراکسید های گروه اصلی، ترکیباتی از ارتباط E-O-O-E (E عنصر گروه اصلی است)
- پراکسیدها و اکسیدکننده های فلزات مانند پراکسید سدیم (Na2O2)، پراکسید باریوم( BaO2)، پراکسید زینک (ZnO2). فلزات قلیایی و همچنین فلزات قلیایی خاکی، نیز تشکیل پراکسید می دهند. تعدادی دیگر از فلزات الکتریکی مثبت مانند لانتانوئیدها نیز پراکسید تشکیل می دهند. این فلزات از نظر خصوصیات، واسطه ای بین پراکسیدهای یونی و پراکسیدهای اساسی کووالانسی هستند که توسط فلزاتی مانند روی (Zn) ، کادمیوم (Cd) و جیوه (Hg) تشکیل شده اند. یون پراکسید،O22−، دارای پیوند کووالانسی منفرد اکسیژن-اکسیژن و عدد اکسایش 1 – روی اتمهای اکسیژن است. یون پراکسید یک پذیرنده قدرتمند یون هیدروژن است و باعث می شود پراکسیدهای فلزات قلیایی و فلزات قلیایی خاکی به عنوان پایه های محکمی تبدیل شوند. محلول های این پراکسیدها به دلیل واکنش یون پراکسید با آب، به عنوان یک اسید ضعیف عمل می کند.
- پراکسیدها و اکسیدکننده های آلی (ارگانیک) که مولکول های آنها دو پیوند اتم اکسیژنی دارند که تمایل به فروپاشی دارند. یک پراکسید ترکیبی است که یا حاوی پراکسید آنیون است و یا پیوند منفرد اکسیژن-اکسیژن.
کلام آخر:
عوامل اکسید کننده و پراکسیدهای آلی از طریق وجود اکسیژن در ماده به گونه ای شناسایی می شوند که ممکن است برای شرکت در واکنش های شیمیایی به راحتی آزاد شود. برخی مواد مانند آب، پراکسیدهیدروژن، ازن، دی اکسید فسفر، اسیدنیترو، نیترات سدیم، سولفیت سدیم هم اکسیدکننده و هم کاهنده هستند. صنایع آرال شیمی، با انجام تحقیقات متعدد، توانسته است به محصول سولفورین، با فرمولاسیون خاص دست پیدا کند. این محصول، کاتالیستی بسیار سطح بالا، کنستانتره و اقتصادی برای فرآیند سولفورزدایی از مشتقات نفت و گاز می باشد. سولفورزدایی از مشتقات نفت و گاز، یک فرآیند مهم در صنعت حمل و نقل مانند سوخت کشتی، سوخت جت، هواپیما و سوخت خودروهاست که موجب کاهش آلودگی های زیست محیطی می شود.
⇐ بروزرسانی در تیر 1403
















درود بی پایان بر شما، مطالب بسیار عالی و کاربردی بود، متشکر
سلام، سپاس از لطف و توجه شما به مقالات، خوشحالیم که مورد توجه شما واقع شده.
جالب بود .تشکر
درود بر شما همراه گرامی؛
سپاس از حسن توجه و نگاه نیک شما
سلام وقت بخیر برای اکسید کردن قرص ها از چه نوع اسیدی استفاده میشود؟
درود بر شما همراه گرامی؛
برای اکسید کردن یا حل کردن قرصها، معمولاً از اسیدهای قوی مثل اسید نیتریک، سولفوریک یا کلریدریک استفاده میکنن. اگه بحث اکسید کردن باشه، ترکیب اسید با یه مادهی اکسیدکننده مثل پراکسید هیدروژن یا پرمنگنات پتاسیم هم جواب میده. این کار بیشتر تو آزمایشگاهها انجام میشه و خیلی مهمه که با احتیاط انجام بشه، چون این مواد میتونن خطرناک باشن!
سپاس از توجه شما
سلام خیلی ممنون از سایتتون که اطلاعات
خوبی رو به مخاطبین داد بنده 1 سوال داشتم پزودوافدرین رو هم میشه اکسید کرد
درود بر شما همراه گرامی؛
خرسندیم که مطالب مورد توحه شما قرار گرفته. در پاسخ به سوال شما باید گفت که بله، پزودوافدرین قابلیت اکسید شدن به ترکیبات مختلفی رو داره. با اکسیدکنندههای ملایم مثل PCC یا MnO₂ به نورافدرین تبدیل میشن، درحالیکه اکسیدکنندههای قوی مثل پرمنگنات پتاسیم یا کرومیک اسید میتونن اون رو به کاتینون تبدیل کنن. همچنین، ممکنه به ایمینها یا مشتقات حلقوی تبدیل بشه. توجه کنید که محصول نهایی به نوع اکسیدکننده، شرایط واکنش (pH، دما، حلال) و ترکیبات جانبی بستگی داره.
سپاس از توجه شما